特定臨床研究
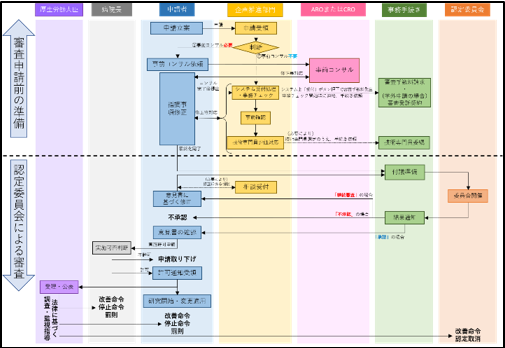
臨床研究の主な流れ(厚生労働省)
新規申請に必要な、①~④の手順についてご案内します。
「臨床研究法の概要(令和2年7月7日)より抜粋:23枚目」
https://www.mhlw.go.jp/content/10800000/000647734.pdf
①研究責任医師が作成する資料
慶應義塾臨床研究審査委員会の新規申請に必要な書類は、以下の通りです。
詳細は以下の臨床研究審査委員会のリンクを参照してください。
https://www.ctr.med.keio.ac.jp/nintei/process/document.html
|
【1】 |
実施計画【厚労省 様式第一】 |
|
jRCTに入力したものを出力したファイルでも可 |
|
|
【2】 |
|
|
【3】 |
|
|
【4】 |
説明同意文書 |
|
【5】 |
|
|
【6】 |
※研究計画書に記載されていれば別途作成不要。 |
|
【7】 |
※研究計画書に記載されていれば別途作成不要。 |
|
【8】 |
※監査を行う場合は必須。 |
|
【9】 |
※研究計画書に記載されていれば別途作成不要。 |
|
【10】 |
|
|
【11】 |
その他認定委員会が提出を求める書類 |
②慶應義塾臨床研究審査委員会
手続きに関するリンクは、以下の通りです。
新規申請での審査の流れ
https://www.ctr.med.keio.ac.jp/nintei/process/
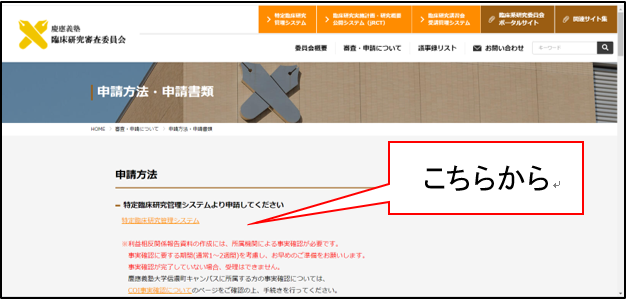
申請方法
https://www.ctr.med.keio.ac.jp/nintei/process/document.html
研究者の方へ:特定臨床研究の申請・ヒアリング・実施の手引
https://www.ctr.med.keio.ac.jp/nintei/process/guidance.html
③実施医療機関の管理者の許可
認定臨床審査委員会の審査後、実施医療機関の管理者の許可に関する手順は以下の2パターンとなります。
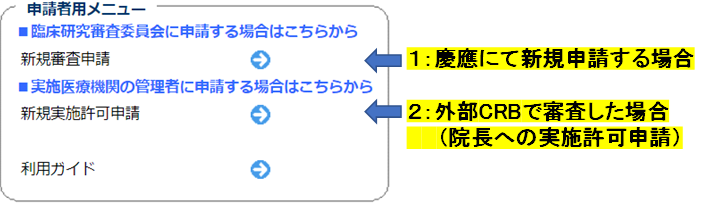
1:慶應義塾臨床研究審査委員会にて審査した場合
特定臨床研究管理システムより、案内メールが送付される。
2:当院以外の認定臨床研究審査委員会で審査した場合
特定臨床研究管理システムの「新規実施許可申請」より申請する。
https://keio2.bvits.com/crb/login_front.aspx?ReturnUrl=%2fcrb%2fCommon%2f
④実施計画の厚生労働大臣への提出(DB上で手続き)
https://www.mhlw.go.jp/content/10800000/000370962.pdf