再生医療等支援部門
【New!】再生医療等実用化基盤整備促進事業東日本におけるiPS細胞等臨床研究推進モデル病院のウェブサイトを新たに公開しました
再生医療等支援部門(RM部門)では、学内をはじめ、他大学や学外の医療機関で実施されている細胞加工物や再生医療等製品の研究開発支援を行っています。主にアカデミアにおいて行われている様々な疾患や病態、生理現象を対象とする基礎研究から、海外で既に使用されている細胞加工物や再生医療等製品を用いた臨床研究等まで幅広く支援を行うことで、再生医療等を迅速に患者さんに届けられるよう活動しています。
RM部門は、以下の2つのユニットで構成されており、それぞれのユニットが密接に連携して業務支援を行っています。
またRM部門は、国立研究開発法人日本医療研究開発機構(AMED)による再生医療領域の各種研究開発事業に参画し、その推進に協力しています。
再生医療等支援ユニット
役割
研究シーズ等の各開発段階における研究費申請等のサポートから、人に投与するまでの流れの中で様々なニーズに対応した支援を実施いたします。
医薬品・医療機器シーズと比べて少なからず異なる対応が求められる
「再生医療等シーズ」に特化した研究開発支援に対応します。
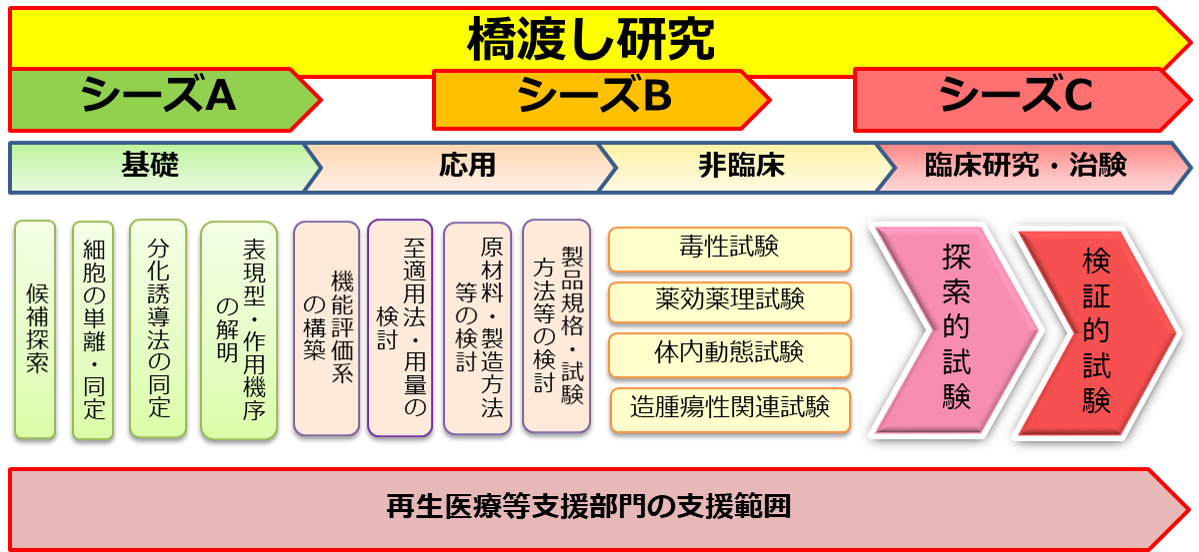
基礎から臨床への一気通貫した支援、シーズ開発に必要なリソースを提供いたします。
●基礎研究の成果を実用化するために必要なレギュラトリーサイエンスに基づく支援
●対象の再生医療等シーズ全体を捉えたプロジェクトマネジメント支援
相談フロー・支援の流れ

▶お気軽にご相談いただけます。下記のお問い合わせフォームより、ご連絡ください
具体的なご相談事例とご支援の内容

法令等の規制に対する適切な助言や、各種資料作成の支援および管理を行っています。
再生医療等シーズの研究開発支援として、研究開発に役立つ文書を提供しています。
●PMDA薬事相談 対面助言の相談資料ひな型(品質・非臨床試験)※無断転載禁止※
アカデミアの研究者がPMDA薬事相談(対面助言)で円滑で十分な議論ができるよう、RS戦略相談のためのイントロダクションおよび相談資料ひな型を作成しました。
下記よりダウンロードし、お使いいただけます。
・遺伝子組換え細胞治療(ex vivo遺伝子治療)に対応するPMDA品質相談資料ひな型(データは2025年6月中に公開予定)
●再生医療等の実施の流れ(臨床研究) ※学内専用※
再生医療等の安全性の確保等に関する法律(平成 25 年法律第 85 号)」第 2 条第 1 項に規定された「再生医療等」に該当する臨床研究(治療は除く)の実施に必要な、慶應義塾大学病院での手順をまとめた資料を作成しました。
・再生医療等の実施の流れ(臨床研究) ※学内専用※
▶お気軽にご相談いただけます。下記のお問い合わせフォームより、ご連絡ください。
これまで支援に携わった再生医療シーズにおけるニュースリリース(一部)
- 「難治性重症心不全患者を対象とした同種iPS細胞由来再生心筋球移植の安全性試験」の臨床研究について
- 子宮頸がんを対象とした腫瘍浸潤リンパ球輸注療法(TIL療法)の先進医療実施について
- 「水疱性角膜症に対するiPS細胞由来角膜内皮代替細胞移植の安全性及び有効性を検討する探索的臨床研究」を慶應義塾特定認定再生医療等委員会が承認
- 「特発性周辺部角膜潰瘍およびcGVHDに伴う角膜潰瘍に対するヒト脂肪由来間葉系幹細胞の安全性を検討する探索的試験」について-眼科領域における再生医療応用プロジェクトの適合性確認
▶お気軽にご相談いただけます。下記のお問い合わせフォームより、ご連絡ください
細胞調製等支援ユニット
役割
細胞培養加工等、人に投与する細胞加工物を製造する施設の提供や、製造に関する業務の支援を実施いたします。細胞培養加工施設については、下記ページをご覧ください。
再生医療等支援部門に関連する事業
再生医療等支援部門では、再生医療に関連する以下2つの研究開発事業を進めています。
東日本におけるiPS細胞等臨床研究推進モデル病院の充実
当院ではiPS細胞等の高度な技術を要する臨床研究や医師主導治験等の支援・受け入れに対応できる「iPS細胞等臨床研究モデル病院」の充実に取り組んでいます。
詳しくは下記ページをご覧ください。
iPS細胞等臨床研究推進モデル病院事業
https://www.ctr.hosp.keio.ac.jp/rmmh/
ヒト(同種)体性幹細胞原料の安定供給促進事業
当院では再生医療等製品の製造等に利用可能なヒト(同種)体性幹細胞原料を製薬企業等に継続的かつ安定した品質で提供できる体制の構築に取り組んでいます。
詳しくは下記ページをご覧ください。
本事業は、令和3~5年度AMED再生医療・遺伝子治療の産業化に向けた基盤技術開発事業(再生医療等製品用ヒト(同種)体性幹細胞原料の安定供給促進事業)の支援を受けています。


