一般の方へ
病院一同、力を合わせて「未来の医療」へ取り組んでいます
2014年に施行された薬機法(医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律)や2018年に施行された臨床研究法に基づき、私たちは臨床研究に日々取り組んでいます。
治験を取り巻く国内外の状況が急速に変化しており、加えて患者さんの日々の診療を支える土台を作る臨床研究も、早急に質・量ともに改善が急務と考えられ、国の施策としても治験・臨床研究の推進を担う中核的機関の整備が図られてきました。慶應義塾大学は、その一環として2006年に医学部クリニカルリサーチセンター(The Center for Clinical Research: CCR)を設置しました。また2014年、このCCRを発展的に改組し、新たに病院臨床研究推進センター(Clinical and Translational Research Center: CTR)を設置して、名実ともに研究室からベッドサイドに至るすべてのプロセスを支えることが可能な体制を整備しています。
当院の臨床研究・治験
臨床研究に関する情報公開(オプトアウト)
臨床研究の現場から
臨床研究とは
臨床研究と治験 臨床研究の種類 臨床研究の倫理性と安全性 新しい薬が生まれるまで臨床研究の進め方 臨床研究コーディネーター
用語の説明
よくお受けする質問(FAQ)
ご参考となるリンク集
お問い合わせ
一般的な医薬品開発の流れ
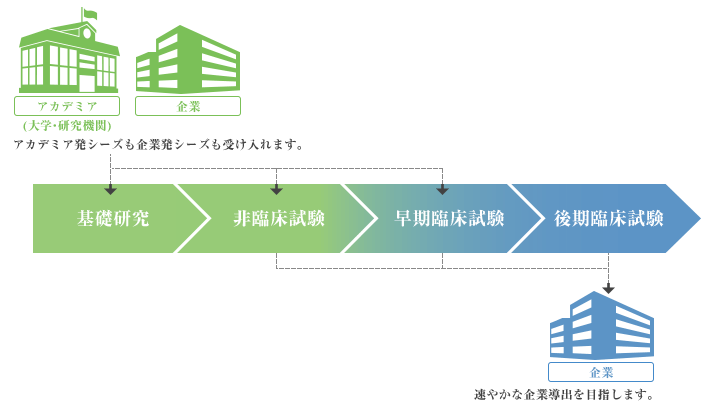
上記の図は、一般的な医薬品開発の流れを示しています。企業においてもアカデミア(大学・研究機関)においても、新薬の候補となる物質が発見された場合は、まず関連知的財産(特許)の出願等適切な対応を行い(基礎研究)、非臨床試験と呼ばれる段階へ進みます。非臨床試験では、候補新薬の安全性・有効性・毒性を確認した後に、初めてヒトへの投与となる早期臨床試験へ進みます。その後、新薬候補の安全性やヒトの体内での反応・ふるまいを確認し、安全性と有効性が新薬として十分期待できると判断された場合には、診療の場で用いることを想定したさまざまな確認を後期臨床試験で実施していくこととなります。最終的に、これらの過程を経て医薬品として使用可能であることが確認できると、厚生労働省へ承認申請を行い、承認されたのちに患者さんの治療に用いられることとなります。大学発の研究シーズについては、主に基礎研究から早期臨床試験を実施しながら、最終的に厚生労働省への申請を行う企業へ導出していくことになります。
どれほど有望な新薬候補であっても、診療の場で実際に薬として用いるための許可を得るには、これらすべてのプロセスを確実かつ迅速に進めることが大切です。とりわけ早期・後期臨床試験は、法律の定めに従って行う臨床試験(治験)を実施することが必須であり、被験者の保護、試験データの信頼性、あるいは関係諸法規や試験計画の遵守など、さまざまな点において高い水準で実施することが求められます。こうしたプロセスは、医療機器や再生医療等製品の開発においても同様です。
開発医薬品・医療機器の中には、採算性などの問題から製薬企業が開発に積極的でない希少疾患の治療薬や、未だ安全で有効な治療が確立されていない難治性疾患の治療等もあり、従来とは全く異なる発想に基づく新たな治療を、医師が自ら研究開発することが求められることがあります。この研究開発の一連の流れを、医師・研究者がすべて担うことは不可能であり、法的規制、統計解析、企業折衝、資金管理など、さまざまな分野の専門家がチームとして研究開発を支える体制が不可欠です。また、最終的に新規医薬品・医療機器を診断・治療のために製造・販売するのは企業の役割となることから、こうした企業との連携も必要となります。新規の医薬品・医療機器等の研究開発から企業導出までを総合的にサポートするのが、私たち臨床研究推進センターの使命です。
慶應義塾大学病院では現在、約180件ほどの治験と、およそ2,000件ほどの治験以外の臨床研究を実施しています。臨床研究推進センターは100名を超えるスタッフを擁し、これら当院で行われる治験・臨床研究のほか、他の医療機関で行われる治験や臨床研究も様々な形で支えています。
