製造販売後調査の申し込みについて
当院では2026年2月受付分より製造販売後調査の実施手続きおよび審査体制が変更されます。本ページの内容をご確認の上、手続きをお願い致します。
詳細はこちらをご覧ください。
なお、すでに契約締結済で実施中の調査に関しては再契約の必要や手順の変更はございません。
調査依頼者各位
製造販売後調査については本ページの内容をご確認の上、申請手続きを行ってください。
なお、製造販売後臨床試験については、治験に準じた手続きとなるので、こちらをご参照ください。ご不明の点は、治験事務局までお問い合わせください。
申請前に以下をご確認ください。
- 調査対象となる製品は、当院の採用医薬品、採用医療機器、採用再生医療等製品です。
- 申請前に診療科部長(統括責任者)に実施の了承を得てください。また、責任医師に調査実施要綱・契約内容・調査金額・支払い方法について説明し、内諾を得てください。
- 医薬品による副作用/感染症報告のご相談は薬剤部医薬品情報室へご連絡ください。
- すべての新規申請でIRB審議が必要となります。また、EDCを使用する場合はシステム部への連絡が必要です。
- 契約書は当院のひな型をご使用ください。
- 調査費用については費用規定に記載しております。単価金額を含む金額の変更はできません。
調査対象について
医薬品/治験機器/再生医療等製品の一般使用成績・特定使用成績・使用成績比較申請が対象となります。
また、調査対象となる製品は、当院の採用医薬品、採用医療機器、採用再生医療等製品のみです。
※医薬品による副作用/感染症報告のお問い合わせ、申し込みは薬剤部医薬品情報室へお願いします※
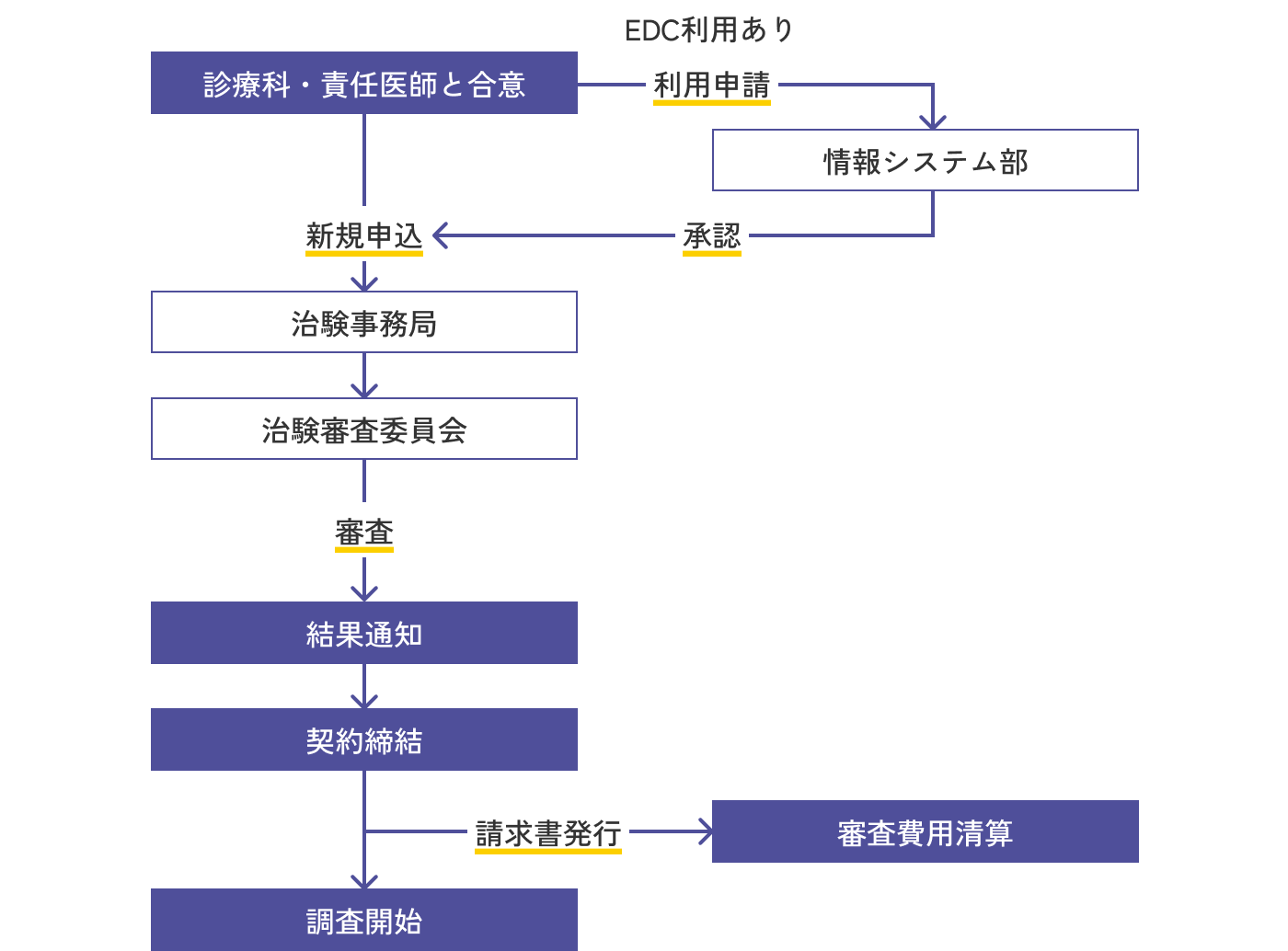
手続きの流れ
- 新規申請の際は事前に診療科部長(統者責任者)に実施の了承を得てください。また、責任医師に調査実施要項・契約内容・調査金額・支払い方法について説明し、内諾を得てください。
- EDCを使用する場合は、システム部の承認が必要ですので所定の手続きをしてください。
- 調査開始前に治験審査委員会の審査が必要です。開催日や申請締め切りなど、IRBのスケジュールはこちらの「開催予定日」よりご確認ください。
- 調査開始後の審査資料の変更手続きには治験審査委員会の審議が必要です。なお、契約書記載内容の変更を伴う際は早めに治験事務局へご連絡ください。
詳細は製造販売後調査申込の手引きをご確認ください。
調査開始までの流れ
申請書類について
契約書は当院のひな型をご使用ください。
一部を除き、文言の変更はできません。変更時は協議の上覚書対応をお願いしております。
必要書類は下記リストからダウンロードできます。最終必要書類をご確認の上、治験事務局に提出(メールまたは郵送)してください。
| 書類名称 | 備考 |
|---|---|
| 製造販売後調査に関する契約書(二者契約) | 必須(二者契約時) |
| 製造販売後調査に関する契約書(三者契約) | 必須(三者契約時) |
| 契約内容変更に関する覚書 | 原契約変更時必須 |
| 製造販売後調査業務覚書 | 二者→三者へ変更時必須 |
| 製造販売後調査申込書 | 必須 |
| 調査費用算定書 | 必須 |
| 調査分担医師リスト | 必須 |
| 調査用試料等一覧 | 必須 |
| 審査申込書 | 必須 |
| 製造販売後調査申込の手引き | 配布のみ |
| 費用規定 | 配布のみ |
| 製造販売(市販)後調査の支払い手続きについて | 配布のみ |
費用について
- 費用の詳細は費用規定をご参照いただき、調査費用算定書に必要事項を記入の上、契約書とともに提出してください。単価金額を含む金額の変更はできません。
- 治験審査委員会での審査料は調査の内容により異なりますので、費用規定で確認ください。契約締結後に請求書を送付いたします。
- 調査票作成費は実績に応じた出来高払となります。 原則、毎年度末および終了報告時にお支払いとさせていただきます。
詳細は製造販売(市販)後調査の支払い手続きについてをご確認ください。
資料・その他
ご不明な点は治験事務局(keio-chiken@adst.keio.ac.jp)へお問い合わせください。
